1 Amini Boroujeni, N, Hassanshahian, M and Khoshrou, M R““Isolation and characterization of phenol degrading bacteria from Persian Gulf””, International Journal of Advanced Biological and Biomedical Researc, (2014), Vol. 2, No. 2, pp. 408-416.
2 Beller, H R, Grbic-Galic, D and Reinhard, M““Microbial degradation of toluene under sulfate-reducing conditions and the influence of iron on the process””, Applied and Environmental Microbiolog, (1992), Vol. 58, No. 3, pp. 786-793.

3 Botello, A V, Villanueva, S F, Diaz, G G and Escobar-Briones, E““Polycyclic aromatic hydrocarbons in sediments from salina cruz harbour and coastal areas, Oaxaca, Mexico””, Marine Pollution Bulletin, (1998), Vol. 36, No. 7, pp. 554-558.

4 Boudreau, B P and Canfield, D E““A comparison of closed- and open-system models for porewater pH and calcite-saturation state””, Geochimica et Cosmochimica Act, (1993), Vol. 57, No. 2, pp. 317-334.

5 Chen, C W and Chen, C F““Distribution, Origin, and Potential toxicological significance of polycyclic aromatic hydrocarbons(PAHs) in sediments of Kaohsiung Harbor, Taiwan”, Marine Pollution Bulletin, (2011), Vol. 63, pp. 417-423.


6 Coates, J D, Woodward, J, Allen, J, Philp, P and Lovley, D R““Anaerobic Degradation of Polycyclic Aromatic Hydrocarbons and Alkanes in Petroleum-Contaminated Marine Harbor Sediments””, Applied and Environmental Microbiology, (1997), Vol. 63, No. 9, pp. 3589-3593.



7 Hassanshahian, M, Abarian, M and Cappello, SBiodegradation and Bioremediation of Polluted Systems-New Advances and Technologies Chapter 6. “Biodegradation of Aromatic Compounds”. (2015), Edited Volume, p. 176.
8 Hassanshahian, M““The effects of crude oil on marine microbial communities in sediments from the Persian Gulf and the Caspian Sea: a microcosm experiment””, International Journal of Advanced Biological and Biomedical Research, (2014), Vol. 2, No. 1, pp. 1-17.
9 Haritash, A K and Kaushik, C P““Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs): A review””, Journal of Hazardous Materials, (2009), Vol. 169, No. 1-3, pp. 1-15.


10 Harmsen, J, Wieggers, H J J, van de Akker, J J H and van Diik-Hooyer, O M““Intensive and extensive treatment of dredged sediments on landfarms””, Bioremediation international symposium 4th, (1997), Vol. 2, pp. 153-158.
11 Hunter, R D, Ekunwe, S I N, Dodor, D E, Hwang, H M and Ekunwe, L““Bacillus subtilis is a potential degrader of pyrene and benzo(a)pyrene””, International Journal of Environmental Research and Public Health, (2005), Vol. 2, No. 2, pp. 267-271.



12 Jackson, J B C, Cubit, J D, Keller, B D, Batista, V, Burns, K, Caffey, H M, Caldwell, R L, Garrity, S D and Getter, C D““Ecological effects of a major oil spill on panamanian coastal marine communities””, Science, (1989), Vol. 243, pp. 37-44.


13 Jarvis, I W, Dreij, K, Mattsson, A, Jernstrom, B and Stenius, U““Interactions between polycyclic aromatic hydrocarbons in complex mixtures and implications for cancer risk assessment””, Toxicology, (2014), Vol. 321, pp. 27-39.


14 Johnsen, A R, Wick, L Y and Harms, H““Principles of microbial PAH-degradation in soil””, Environmental Pollution, (2005), Vol. 133, No. 1, pp. 71-84.


15 Karcher, W““Spectral atlas of polycyclic aromatic compounds””, The Netherlands, (1988), Vol. 2, pp. 20-24.
17 Kim, Y H, Kim, Y B, Kim, K, Chang, K I, Lyu, S J, Cho, Y K and Teague, W J““Seasonal variation of the Korea Strait Bottom Cold Water and its relation to the bottom current””, Geophysical Research Letters, (2006), Vol. 33, pp. 1-5.

18 Kim, K R, Kim, S H and Hong, G H““ Remediation technologies for contaminated marine sediments””, Journal of Korean Environmental Dredging Society, (2012), Vol. 2, No. 1, pp. 20-25.
19 Korea coast guard(2008). “Korea Coast Guard White Paper” 2008), 523.
20 Lei, L, Khodadoust, A P, Suidan, M T and Tabak, H H““ Biodegradation of sediment-bound PAHs in field-contaminated sediment””, Water Research, (2005), Vol. 39, pp. 349-361.


21 Lovley, D R, Roden, E R, Phillips, E J P and Woodward, J C““ Enzymatic iron and uranium reduction by sulfate-reducing bacteria””, Marine Geology, (1993), Vol. 113, pp. 41-53.

22 Luo, K, Yang, Q, Li, X M, Yang, G, Liu, Y, Wang, D B, Zheng, W and Zeng, G M““Hydrolysis kinetics in anaerobic digestion of waste activated sludge enhanced by a-amylase””, Biochemical Engineering Journal, (2012), Vol. 62, pp. 17-21.

24 Lu, X Y, Li, B, Zhang, T and Fang, H H P““Enhanced anoxic bioremediation of PAHscontaminated sediment””, Bioresource Technology, (2012), Vol. 104, pp. 51-58.


25 Mackay, D and Callcott, DIn: Neilson AH, “Partitioning and physical chemical properties of PAHs PAHs and Related Compounds”, editors. The Handbook of Environmental Chemistry. (1998), 3Part I):Springer; Berlin, Heidelberg: p. 325-346.
26 Ministry of Oceans and Fisheries. Official Test Criteria the Marine Environment 2013.
27 Nikolaou, K, Masclet, P and Mouvier, G““Sources and chemical-reactivity of polynuclear aromatic hydrocarbons in the atmosphere-A critical-review””, Science of the Total Environment, (1984), Vol. 32, No. 2, pp. 103-132.

28 Nasr, I N, Arief, M H, Abdel-Aleem, A H and Malhat, F M““Polycyclic Aromatic Hydrocarbons (PAHs) in Aquatic Environment at El Menofiya Governorate, Egypt””, Journal of Applied Sciences Research, (2010), Vol. 6, No. 1, pp. 13-21.
29 Peterson, C H, Rice, S D, Short, J W, Esler, D, Bodkin, J L, Ballachey, B E and Irons, D B““Long-term ecosystem response to the Exxon Valdez oil spill””, Science, (2003), Vol. 302, pp. 2082-2086.


30 Perelo, L W““Review: In situ and bioremediation of organic pollutants in aquatic sediments””, Journal of Hazard Materrials, (2010), Vol. 177, No. 1-3, pp. 81-89.

31 Qiu, Y W, Zhang, G, Liu, G Q, Guo, L L, Li, X D and Wai, O““Polycyclic aromatic hydrocarbons (PAHs) in the water column and sediment core of Deep Bay, South China””, Estuarine, Coastal and Shelf Science, (2009), Vol. 83, No. 1, pp. 60-66.

32 Rabus, R and Widdel, F““Utilization of Alkylbenzenes during Anaerobic Growth of Pure Cultures of Denitrifying Bacteria on Crude Oil””, Applied and Environmental Microbiologh, (1996), Vol. 62, No. 4, pp. 1238-1241.

33 Reimers, C E, Ruttenberg, K C, Canfield, D E, Christiansen, M B and Martin, J B““Porewater pH and authigenic phases formed in the uppermost sediments of the Santa Barbara Basin””, Geochimica et Cosmochimica Acta, (1996), Vol. 60, No. 21, pp. 4037-4057.

34 Rothermich, M M, Hayes, L A and Lovley, D R““Anaerobic, sulfate-dependent degradation of polycyclic aromatic hydrocarbons in petroleumcontaminated harbor sediment””, Environmental Science Technology, (2002), Vol. 36, No. 22, pp. 4811-4817.


35 Song, Y C, Subha, B, Woo, J H, Lim, H J and Senthilkumar, P““Surface Modification of Sediment with Surfactant for Capping Material on Contaminated Coastal Sediment””, Water Air Soil Pollution, (2014), Vol. 225, pp. 2066-2076.


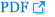
36 Song, Y C, Senthilkumar, P and Woo, J H““Effect of biostimulation on growth of indigenous microorganisms in contaminated marine sediments””, The Korean Society for Marine Environment & Energy, (2013), pp. 49-50.
37 Shin, H S and Song, Y C““A model for evaluation of anaerobic degradation characteristics of organic waste: Focusing on kinetics, rate-limiting step””, Environmental Technology, (1995), Vol. 16, No. 8, pp. 775-784.

38 Song, Y C, Feng, q and Ahn, Y““Performance of the bio-electrochemical anaerobic digestion of sewage sludge at different hydraulic retention times””, Energy & fuels, (2016), Vol. 30, pp. 352-359.

39 Subha, B, Song, Y C and Woo, J H“An experimental design approach to optimize the effectiveness of biostimulant ball in coastal sediment”, 2014), In: International conference on emerging trends in computer and image processing(ICETCIP, 2014); Dec. 15-16; Pattaya(Thailand). pp 62-65.
40 US EPA. “Quality Criteria for Water 1986 EPA 440/5-86-001” 1987), US Environmental Protection Agency; Washongton DC.
41 Woo, J H, Subha, B and Song, Y C““Effect of the Applied Biostimulant Depth on the Bioremediation of Contaminated Coastal Sediment””, Journal of Navigation and Port Research, (2015), Vol. 39, No. 4, pp. 345-351.

42 Woo, J H, Subha, B and Song, Y C“Application of biostimulant ball depth effect in contaminated coastal sediment to evaluate the PAHs degradation and enhance the bacterial community using pyrosequencing”, 2016), In: 8th International Conference on Marine Pollution and Ecotoxicology; June 20-24; Hong Kong. pp 69.
43 Woo, J H, Song, Y C and Senthilkumar, P““Study on the elution of biostimulant for in-situ bioremediation of contaminated coastal sediment””, Journal of Navigation and Port Research, (2014), Vol. 38, No. 3, pp. 239-246.

44 Wang, Y and Cappellen, P V““A multicomponent reactive transport model of early diagenesis:Application to redox cycling in coastal marine sediments””, Geochimica et Cosmochimica Acta, (1996), Vol. 60, No. 16, pp. 2993-3014.

45 Walworth, J, Pond, A, Snape, I, Rayner, J, Ferguson, S and Harvey, P““Nitrogen requirements for maximizing petroleum bioremediation in a sub-Antarctic soil””, Cold Regions Science and Technology, (2007), Vol. 48, pp. 84-91.

46 Yuan, S Y and Chang, B V““Anaerobic degradation of five polycyclic aromatic hydrocarbons from river sediment in Taiwan””, Journal of Environmental Science and Health Part B=Pesticides Food Contaminants and Agricultural Wastes, (2007), Vol. 42, No. 1, pp. 63-69.


47 Zeng, Y, Hong, P K A and Wavrek, D A““Integrated chemical-biological treatment of benzo[a]pyrene””, Environmental Science & Technology, (2000), Vol. 34, No. 5, pp. 854-862.




 PDF Links
PDF Links PubReader
PubReader Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print