연안오염퇴적물에 주입한 생물활성촉진제의 깊이가 생물정화효율에 미치는 영향
Effect of the Applied Biostimulant Depth on the Bioremediation of Contaminated Coastal Sediment
Article information
Abstract
실험실 규모의 관 실험을 통하여 연안오염퇴적물의 생물정화 효능에 대한 생물활성촉진제 주입 깊이의 영향을 평가하였다. 생물활성 촉진제를 실험관에 충진 된 오염퇴적물의 표면과 표면으로부터 3cm, 6cm, 10cm 위치에 주입한 후 1개월 및 3개월 후 퇴적물의 유기물 및 중금 속의 특성 변화를 조사하였다. 시험 오염퇴적물의 화학적 산소요구량, 총고형물 및 휘발성고형물 함량은 생물활성촉진제를 주입하지 않은 대조 구에 비해 1개월 후 및 3개월 후에서 크게 감소하였으며, 생물활성촉진제 주입 깊이 3cm에서 최대값을 보였다. 그러나, 오염퇴적물에 주입한 생물활성촉진제의 깊이를 6cm 및 10cm로 증가하였을 때 유기오염물질 감량정도는 점차 감소하였다. 중금속 존재형태변화는 생물활성촉진제 주입 깊이 3cm에서 안정한 형태인 유기물 결합분율과 광물내 잔류분율이 현저하게 증가하였다. 오염퇴적물의 현장생물정화를 위한 최적의 생 물활성촉진제 주입 깊이는 퇴적물의 상부 표면으로부터 3cm로 평가되었다.
Trans Abstract
This study investigated the optimum depth for the application of bioremediation in contaminated coastal sediment using a lab scale column experiment. The biostimulants were placed in the top surface of the sediment facing seawater, 3cm, 6cm and 10cm of the depth from the surface, respectibely. During the experiment, the changes of organic pollutants and heavy metal fractions in the sediment were monitored in 1 month and 3month time intervals. The organic pollutants found during various analysis such as chemical oxygen demand, total solids and volatile solids, significantly reduced when the depth of the biostimulant was 3cm or less. In contrast, at a depth of over 6cm, the reduction of organic pollutants decreased, and the results were similar to the control. Heavy metals fractions in the sediment also changed with the depth of the biostimulants. The exchangeable fraction of the metals was quite reduced at the sediment surface in the column, but the organic bound and residual fractions considerably increased at a depth of 3cm. Based on this study, the optimum biostimulants depth for in-situ bioremediation of contaminant coastal sediment is 3cm from the sediment surface.
1. 서 론
도시에 인접한 연안해역의 퇴적물은 육상기인의 다양한 난분해성 유기오염물질과 독성이 강한 중금속들로 오염된 경 우가 많다. 이러한 연안해역의 오염된 퇴적물은 바람이나 선 박운항, 준설작업 등에 의해서 유발되는 해수의 물리환경 변 화에 의해 수계로 재부상할 수 있다. 연안퇴적물이 재부상하 는 경우 연안퇴적물에 함유되었던 여러 가지 오염물질들은 수계로 쉽게 용출될 수 있다 (Song et al. 2014a). 따라서, 오 염된 연안퇴적물은 퇴적물에 내부 또는 수계를 터전으로 살 아가는 다양한 해양생물들의 생육에 부정적인 영향을 미칠 수 있으며, 연안역을 터전으로 살아가는 인간의 건강을 크게 위협할 수 있다. 따라서, 최근에는 오염된 연안퇴적물의 관리 에 대한 관심 크게 높아지고 있으며, 오염퇴적물을 정화하기 위하여 다양한 노력들을 경주하고 있다 (Asaoka et al., 2009; Woo et al., 2014; Harada et al., 2014). 지금까지 연구 되어온 오염연안퇴적물의 정화기술로는 준설, 피복 그리고 현장생물정화 등이 있다(Kang et al., 2014; Woo et al., 2014; USEPA, 2005). 그러나, 준설법은 준설선과 같은 고가 의 특별한 장비나 시설이 필요하며, 폐기물로 분류되는 준설 물의 처리 및 최종처분이 별도로 필요하다는 단점이 있다 (Perelo, 2010; Song et al., 2014b). 피복법은 모래와 같은 물 질로 오염퇴적물과 수계 사이를 차단하는 막을 형성시켜 오 염퇴적물을 고립시키는 기술이다. 피복법은 준설법에 비하여 경제적인 기술로 알려지고 있으나 오염물질이 현장에 그대로 잔류하게 됨으로서 피복면이 손상될 경우 오염물질 차단 기 능을 상실할 수 있다는 단점이 있다 (Perelo, et al., 2010). 현장생물정화기술은 미생물의 대사작용을 오염물의 정화에 적극 활용하는 기술로서 가장 경제적이며 신뢰성이 높은 방 법으로 알려지고 있다(Kim et al., 2012; Beller et. al., 1992). 현장생물정화기술은 정화하고자 하는 대상 오염물질을 대사 하여 분해하는 능력을 가진 미생물을 외부에서 배양하여 주 입하는 외래미생물주입기술(Nikolopoulou, et al., 2013; Suja, et al., 2014)과 오염된 연안퇴적물에 자생하는 미생물의 활성 을 촉진시켜 오염물에 대한 자가 정화력을 향상시키는 생물 활성촉진기술(Nikolopoulou, et al., 2013; Suja, et al., 2014; Woo et al., 2014)로 구별된다. 외래 미생물주입기술은 미생 물을 배양하는 조건과 오염 현장의 환경조건이 차이가 있는 경우 종종 현장에서 만족할 만한 정화성능을 보이지 않는 경 우가 있다(Nikolopoulou, et al., 2013; Suja, et al., 2014). 생 물활성촉진기술은 오염현장의 척박한 환경으로 자생미생물들 의 성장이 제한을 받고 있다는 점에 착안하여 영양분 등과 같이 자생미생물의 성장을 촉진시키는 물질을 주입하는 방법 이다(Nikolopoulou, et al., 2013; Suja, et al., 2014). 지난 수 년간 수행한 생물활성촉진기술에 대한 연구에서는 질소와 인 그리고 황산염, 초산으로 이루어진 생물활성촉진물질을 오염 퇴적물에 주입한 경우 유기오염물질의 정화뿐만 아니라 오염 퇴적물의 중금속으로 인한 위해성도 감소시킬 수 있는 것으 로 평가되었다(Song et al., 2013). 또한, 이러한 생물활성촉 진물질들은 황토 또는 오염되지 않은 퇴적물과 혼합하여 구 형으로 만들고 표면을 셀룰로즈아세테이트, 폴리술펀 등의 고분자 물질로 피복하면, 오염퇴적물 정화에 더욱 효과적으 로 활용할 수 있다고 보고하고 있다(Woo et al., 2014). 생물 활성촉진물질을 볼형태로 만들어 사용하는 경우 생물활성촉 진물질들을 주변의 오염퇴적물로 오랜시간 동안 지속적으로 공급함으로서 오염퇴적물에 자생하는 미생물들의 활성을 촉 진하여 오염물질을 정화할 수 있다고 보고하고 있다(Woo et al., 2014). 한편, 연안오염퇴적물의 현장정화 효능은 볼 형태 의 생물활성촉진제의 크기와 투입간격에 의해서도 크게 영향 을 받는 것으로 알려지고 있는데 연구자들은 각각 3cm 및 5.5cm의 생물활성촉진제의 크기 및 간격을 추천하고 있다 (Subha, et al., 2014). 그러나, 생물활성촉진제를 연안오염퇴 적물에 적용하는 현장생물정화기술로 활용되기 위해서는 연 안오염퇴적물의 정화 효율에 영향을 미칠 수 있는 중요한 인 자 중 하나인 생물활성촉진제의 투여 깊이결정이 필요하다.
따라서, 본 연구에서는 실험실 규모의 관에 오염퇴적물을 충진하고 퇴적물의 상부에 해수를 충진한 후 볼 형태의 생물 활성촉진제를 오염퇴적물의 상부 표면과 3cm, 6cm, 10cm 깊 이로 위치시키고 시간에 따른 유기오염물질 및 중금속의 상 태변화를 관찰함으로서 생물활성촉진제의 주입 깊이에 따른 연안오염퇴적물의 정화효율을 평가하였다.
2. 실험재료 및 방법
2.1 저질 시료의 물리화학적 특성
본 연구에 사용된 연안오염퇴적물 시료는 B 광역시 북항 해역에서 반빈그랩 채니기를 사용하여 채취하였으며, 실험실 로 이동시켜 물리화학적 특성을 분석한 뒤 실험실 규모의 아 크릴 관을 이용한 생물정화실험에 사용하였다. 생물활성촉진 제의 제작에 사용된 오염되지 않은 퇴적물은 B 신항 준설토 투기장에서 채취하였다. 실험에 사용된 해수는 B 광역시 북 항인근 해안에서 채취하였다. 연안오염퇴적물 및 B 신항 준 설토투기장 퇴적물의 물리화학적 특성과 실험에 사용된 해수 의 초기성상은 Table 1과 같다.
2.2 생물활성촉진제(Biostimulant ball) 제작
관 실험에 사용한 생물활성촉진제는 Song 등(2013)의 방 법에 따라 볼 형태로 제작하여 준비하였다. 생물활성촉진제 제작방법은 B 신항 준설토 투기장에서 채취한 오염되지 않 은 퇴적물 시료 1kg에 연안오염퇴적물에 자생하는 토착미생 물의 생리활성을 촉진하는 물질인 황산염(Na2SO4), 질산염 (KNO3) 그리고 초산(C2H3NaO2)을 각각 71.02g, 101.01g 및 41g을 첨가하여 혼합한 후 실온에서 약 48시간 동안 부분 건조하였다(Song et al., 2013; Woo et al., 2014). 이후 이전 연구결과((Subha et al., 2014)를 참고하여 수작업으로 직경 은 3cm 볼을 만들었으며, 60℃에서 48hr 동안 건조시킨 후 고분자 물질인 폴리설펀(Sigma-Aldrich chemicals, USA)으 로 코팅함으로서 미생물활성촉진제를 완성하였다(Song et al., 2013; Woo et al., 2014; Subha et al., 2014). 이때 코팅 에 사용된 폴리설펀 용액은 폴리설펀 10%wt에 N,N-dimethyl acetamide (Junsei chemicals, Japan) 90%wt 와 혼합하여 준비하였으며, 코팅작업은 건조된 볼을 폴리설 펀 용액에 침지시킨 후 약 25℃ 수욕조에서 교화시키는 과정 을 2회 반복하여 행하였다. 코팅이 완료된 생물활성촉진제는 60℃에서 건조하여 실험에 이용하였다.
2.3 생물활성촉진제 주입깊이의 영향평가
상부가 개방된 직경 20cm, 높이 60cm의 원통형 아크릴 관 10개를 준비한 후 각각에 오염퇴적물 시료를 약 10L 씩 을 충진하여 회분식 실험을 수행하였다. 볼 형태의 생물활성 촉진제는 오염퇴적물 시료를 충진하는 과정에 오염퇴적물 층 내부의 계획된 깊이에 위치하도록 주입하였다. 오염퇴적물의 충진이 완료된 관의 상부에는 북항해역에서 채취한 해수를 충분히 충진한 뒤 약 19℃ 내외로 유지되는 항온조에 설치하 였다. 이때 아크릴 관 실험에서 오염퇴적물 층에 주입한 생 물활성촉진제의 깊이는 충진된 오염퇴적물 표면과 표면으로 부터 각각 3cm, 6cm 및 10cm가 되도록 하였다. 오염퇴적물 의 정화효율에 대한 생물활성촉진제 깊이 영향을 평가하기 위한 실험관은 상기한 4가지 조건에서 동일한 방법으로 2개 씩 준비하였으며, 생물활성촉진제를 주입하지 않은 2개의 관 은 별도로 준비하여 대조구로 사용하였다. 실험시작 후 5일 간격으로 충진 오염퇴적물 상부 해수의 온도와 pH 변화를 관찰하였으며, 1개월 및 3개월 후에 각 조건의 실험관 1개씩 을 선정하여 오염퇴적물 시료를 인발하였으며, 생물활성촉진 제를 제거한 뒤 생물활성촉진제 주변반경 5cm 부근의 시료 를 취하여 잘 섞은 후 물리화학적 특성을 2회 반복 분석하였 다.
2.4 분석방법
연안퇴적물 시료를 구성하는 물질의 입도, COD, TS, VS 등의 물리화학적 특성은 해양환경공정시험기준(해양수산부, 2013)에 따라 분석하였으며, 결과들은 퇴적물 건조중량을 기 준으로 나타내었다. 오염퇴적물 시료의 중금속 함량 및 분포 형태는 연안 퇴적물시료를 5단계 연속추출법에 따라 전처리 하여 0.45μm 여과지(PTFE syringe filter, Whatman)로 여과 한 다음 ICP(Inductively Coupled Plasma, Optima 4300DU, Perkin Elmer, MA, USA)를 이용하여 분석하였다 (Tessier et al., 1979; Song et al., 2014a). 본 연구에서 사용한 5 단계 연속추출방법을 설명하면 1단계는 1 M의 MgCl2를 이용하여 실온에서 1시간 교반하여 치환가능분율 (exchangable fraction, F1)을 먼저 추출하고, 2단계는 1 M의 NaOAc을 이 용하여 pH 5에서 5시간 동안 탄산염 결합분율 (carbonate fraction, F2)을 추출한다. 이후 3단계는 0.04 M의 NH2OH HCl 및 25% (v/v) HOAc를 이용하여 96±3℃에서 6시간 동 안 철 및 망간 산화물 형태 (Fe/Mn oxide bound fraction, F3)의 중금속을 추출한다. 4단계는 잔류물로부터 NaOCl을 이용하여 90℃에서 2시간 동안 2회 반복하여 추출하여 유기 물 결합분율 (organic bound fraction, F4)을 결정하고, 마지 막 5단계는 질산으로 10분간 소화시켜 광물내 잔류분율 (residual fraction, F5)을 결정하였다.
3. 실험결과 및 고찰
3.1 생물활성촉진제의 주입깊이에 따른 오염퇴적물의 정 화능
실험실 규모의 관 실험을 통하여 유기오염물질 생물정화에 대한 오염퇴적물에 주입한 생물활성촉진제 깊이의 영향을 평 가한 결과는 Fig. 1과 같다. 관 실험 초기에 오염퇴적물층 상 부 해수의 pH는 약 8.5로 약 알칼리였으며, 실험이 진행되는 동안 pH는 8.0~8.5로서 생물활성촉진제의 주입 깊이에 영향 을 받지 않고 유지하였다(Fig. 1a).
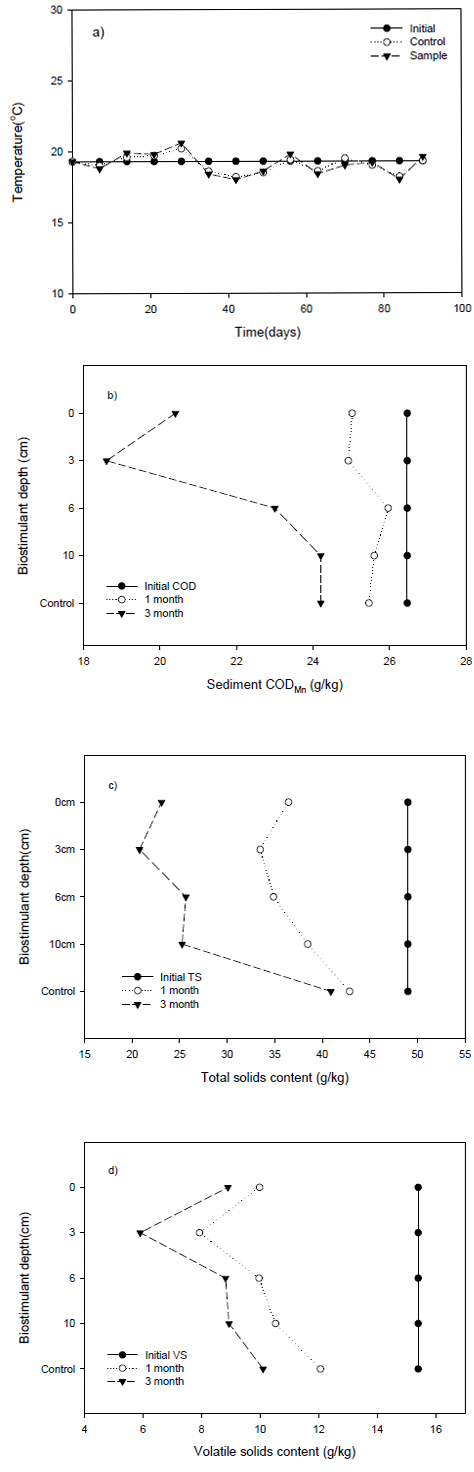
pH(a) changes in seawater inside columns at experimental time, the depth analysis of COD(b), TS(c) and VS(d) of contaminated sediment at different time intervals
또한, 관 실험을 19℃로 유지되는 항온조에서 수행하였기 때문에 전체 실험기간동안 온도의 변화는 거의 없었다. 오염 퇴적물에 주입한 생물활성촉진제 깊이의 영향을 평가하기 위 한 관 실험의 시간이 1개월 및 3개월로 경과함에 따라 오염 퇴적물의 CODMn 함량은 점차 감소하였다. 그러나, 오염퇴적 물이 함유한 CODMn의 감소정도는 생물활성촉진제 주입 깊 이에 따라 차이를 보였다 (Fig. 1b). 오염퇴적물의 초기 COD 함량은 26.5 g/kg이었으나, 생물활성촉진제의 주입 위치가 관에 충진된 오염퇴적물의 표면 및 3cm인 경우 COD 함량 은 실험 시작 1개월 후 약 24.9 g/kg까지 감소하였다. 생물 활성촉진제를 주입한 관형 실험의 오염퇴적물에서 나타난 이 와 같은 COD 함량 감소는 생물활성촉진물질에 의해 오염퇴 적물에 자생하는 미생물의 활성이 촉진되었기 때문이다 (Colwell, 2002; Li et al., 2011). 본 연구에서 사용한 생물활 성촉진제의 구성물질인 황산염, 질산염 그리고 초산 등을 오 염퇴적물에 주입하는 경우 오염퇴적물에 자생하는 미생물의 개체수를 급격히 증가시키는 것으로 보고하고 있다 (Song et al., 2013). 그러나, 관형 실험에서 오염퇴적물에 주입한 생 물활성촉진제의 깊이가 6cm 이상인 경우 1개월 후의 COD 함량은 25.8 g/kg으로서 생물활성 촉진제를 주입하지 않은 대조구의 25.5 g/kg과 큰 차이가 없었다. 이것은 오염퇴적물 의 유기물 분해율은 표층에서 가장 빠르고 깊이가 깊어질수 록 미생물 종의 다양성과 활성이 감소한다고 보고한 이전 연 구결과와 일치한다 (Boetius et al., 2000; Fishcher et al., 2002; Romani et al., 1998; Freixa et al., 2015). 실험 3개월 후 관형 실험에서 오염퇴적물의 COD 함량의 감소는 전체적 으로 1개월 후에 비해 크게 증가하였으며, COD 함량 감소에 대한 생물활성촉진제의 주입 깊이의 영향은 더욱 뚜렷하였 다. 특히, 생물활성촉진제를 실험관에 충진한 오염퇴적물의 표면에 주입한 경우 COD 함량은 20.4g/kg으로 감소하였으 나, 생물활성촉진제 주입 깊이가 3cm인 경우 COD 함량는 18.6 g/kg 으로서 최대 COD 함량 감소를 보였다. 그러나, 1 개월 시료에서와 같이 생물활성촉진제 주입 깊이가 6cm 이 상으로 깊어질수록 COD 함량의 감소는 점차 감소하였다. 생 물활성촉진제 주입 깊이가 10cm에서 COD는 24.2 g/kg으로 서 대조구와 차이가 없었다. 연안 퇴적물에서 유기오염물질 의 분해가 깊이에 따라 차이가 나는 것은 퇴적물의 깊이가 깊어짐에 따라 이용 가능한 전자수용체가 점차 제한되기 때 문으로 평가된다. 아크릴 실험관에 충진된 오염퇴적물 표층 의 산화환원전위는 퇴적물 상부 해수의 용존산소로 인하여 높게 유지되지만 퇴적물의 깊이가 깊어짐에 따라 점차 감소 하는 것이 일반적이다. 황산염과 질산염을 함유한 생물활성 촉진제를 오염퇴적물에 주입한 경우 황산염환원균과 탈질균 의 활성이 유기오염물의 분해에 가장 큰 역할을 한다고 볼 때 실험 관에 충진된 오염퇴적물의 표면에 생물활성촉진제를 주입한 경우가 3cm 깊이에 주입한 경우에 비하여 COD 함 량의 감소율이 낮은 것은 높은 용존산소로 인하여 높아진 산 화환원전위로 황산염환원균과 탈질균의 활성이 저해를 받았 기 때문으로 판단된다. 그러나, 6cm 이상의 깊이에서 COD 함량 감소량이 낮은 것은 이용 가능한 전자수용체의 부족 또 는 황산염환원반응에 의해서 생성된 황화물 등의 독성으로 황산염환원균 및 탈질균의 활성이 저해를 받았기 때문으로 생각할 수 있다. 이결과는 연안오염퇴적물 표층에 해당하는 3cm 내외에 생물활성촉진제를 주입하는 것이 유기오염물질 정화에 가장 효과적임을 의미한다.
Fig. 1c와 Fig. 1d에서는 생물활성촉진제 주입 깊이에 따른 TS 및 VS 함량(g/kg) 변화를 각각 보여주고 있다. 오염퇴적 물의 TS 및 VS 함량 감소의 경우도 COD 함량의 경우와 같이 생물활성촉진제의 주입 깊이에 영향을 받았다. 오염퇴 적물의 TS 및 VS 감량의 경우도 최대값은 COD 함량의 경 우와 같이 생물활성촉진제 주입 깊이가 3cm일 때 이었다. 또한, 생물활성촉진제 주입 깊이가 깊어질수록 TS 및 VS 함량의 감소율은 점차 감소하였다. 그러나, COD 함량의 경 우와는 달리 생물활성촉진제를 주입한 깊이 6cm 및 10cm에 서도 1개월, 3개월에 TS 및 VS 함량 감소현상을 계속하여 관찰할 수 있었다. 오염퇴적물에 생물활성촉진제를 주입하였 을 때 나타난 TS 및 VS 감량이 COD 함량의 경우와 차이 가 나는 것은 황산염환원반응에 의해 생성된 황화물에 의해 오염퇴적물의 산소요구량이 유기물의 분해에 필요한 산소요 구량보다 크기 때문으로 여겨진다. 따라서, 오염퇴적물에 함 유된 유기오염물질 정화를 위해 주입한 생물활성촉진제의 영 향은 COD 함량뿐만 아니라 VS 또는 TS 함량변화 결과를 동시에 이용하여 평가하는 것이 바람직하다 할 수 있다.
3.2 생물활성촉진제 주입깊이에 대한 중금속 안정화 특성
오염퇴적물에서 중금속들의 존재형태는 중금속들의 이동 성이나 생물이용성을 결정하기 때문에 중금속의 위해성을 나 타내는 중요한 지표이다 (Kabala and Singh, 2001; Caeiro et al., 2005). 오염퇴적물이 함유한 중금속들의 존재형태는 용존 산소, pH, 온도, 유기물 함량, 미생물활성변화 등과 같은 환 경변화에 의하여 존재형태가 변화한다 (McLaughlin, 2001; Lu et al., 2005; Song et al., 2014). 본 연구에서 수행한 관 실험에서 오염퇴적물에 주입한 생물활성촉진제의 깊이와 실 험시간에 따른 중금속 분포형태 변화를 대조구와 함께 Fig. 2(a-f)에 나타내었다. 중금속 존재형태는 대부분 생물활성촉 진제 주입 깊이와 실험시간 경과에 따라 크게 변하였다. 특 히, 생물활성촉진제를 실험관에 충진한 오염퇴적물의 표면에 주입한 경우 실험 시작 3개월 후에 실험관에 충진한 오염퇴 적물의 표면에 생물활성촉진제를 주입한 경우 철을 제외한 대부분 중금속들의 치환가능분율은 약 3% 내외로 크게 감소 하였다 (Fig. 3a). 실험관에 충진한 오염퇴적물의 표면에 생 물활성촉진제를 주입한 경우 치환가능한 중금속분율이 크게 감소한 것은 생물활성촉진물질과 높은 산화환원전위로 인한 미생물의 활성증가에 기인하는 것으로 평가되지만 오염퇴적 물의 표면이 해수와 접하고 있기 때문에 치환가능한 중금속 분율의 일부는 해수 중으로 용해되어 확산되었을 여지도 있 다. 일반적으로 치환가능형(F1), 탄산염결합형(F2), 철/망간 산화물 결합형(F3) 중금속들은 이동성이 크고 생물이용가능 성이 높아 독성이 강한 반면에 광물내 잔류형(F5)은 주로 퇴 적물을 구성하는 무기성분들의 결정질 격자들 사이에 합체된 것들로서 매우 안정하며 독성이 거의 없는 것으로 알려지고 있다 (Lu et al., 2005; Song et al., 2014). 유기물 결합형(F4) 은 광물내 잔류형(F5)에 비해 상대적으로 결합력이 약하지만 오염퇴적물의 내부와 같이 환원조건을 유지하는 경우에는 다 른 존재형태들보다는 상대적으로 안정한 것으로 알려지고 있 다 (Lu et al., 2005; Song et al., 2014).

Distribution of heavy metals at varying depths of biostimulant application during experimental time : (a) Cr (b) Cd (c) Cu (d) Zn (e) Pb and (f) Fe

Changes of Heavy metals fractions at different depth (a) exchangeable fraction (F1) (b) Sum of organic bound (F4) and residual fraction(F5)
실험에 사용된 초기의 오염퇴적물에 함유된 중금속들의 존 재 형태 중에서 화학적으로 비교적 안정한 형태로 분류되는 유기물 결합분율(F4)과 광물내 잔류분율(F5)의 합은 Cr과 Cd의 경우 각각 30.4% 및 37.9% 이었으며, Pb와 Fe는 각각 42.7% 및 42.6% 이었다. 그러나, Cu와 Zn의 유기물 결합분 율(F4)과 광물내 잔류분율(F5)의 합은 각각 18.5%와 6.9%로 서 상대적으로 낮았다. 그러나, 오염퇴적물에 주입한 생물활 성촉진제의 깊이가 실험관에 충진한 오염퇴적물의 표면으로 부터 3cm인 경우 3개월 후에 Cd, Cu, Zn, Pb, Fe에 대한 광 물내 잔류분율(F5)과 유기물결합분율(F4)은 모두 증가하였으 며, 그 합은 Fig. 3b에서 보여주는 바와 같이 각각 55.2%, 53.6%, 51.8%, 67.9% 및 62.4%로 크게 증가하였다. 이결과는 오염퇴적물에 생물활성촉진제를 주입하여 중금속의 이동성을 감소시킴으로서 오염퇴적물의 위해성을 저감시킬 수 있음을 나타낸다. 그러나 Cr의 경우 3개월 후에 유기물결합 분율 및 잔류형 분율의 합이 42%로서 증가한 비율이 상대적으로 낮 았다. 오염퇴적물에서 광물내 잔류분율(F5)의 증가한 결과들 이 종종 보고되고 있으나 아직까지 정확한 기작은 밝혀지고 있지 않다. 그러나, 유기물결합분율(F4)의 증가는 황산염환원 균의 활성증가에 기인하는 것으로 판단된다. 미생물의 활성 증가로 오염퇴적물에 함유된 유기물이 분해되면 유기물결합 형 중금속들도 용출될 수 있지만 유기물 분해를 담당하는 미 생물 중의 한가지인 황산염환원균은 환원조건에서 황화물을 생성시킨다. 이때 황산염환원균에 의해 생성된 황화물은 용 출된 중금속들과 결합하여 금속황화물을 생성한다. 금속황화 물 형태의 중금속들은 화학적으로 비교적 안정한 형태로 분 류되며, 연속추출법으로 전처리하여 분석할 경우 유기물결합 분율(F4)에 측정된다 (Song et al., 2014). 오염퇴적물에 주입 한 생물활성촉진제의 깊이가 10cm인 경우는 실험 3개월 후 의 유기물 결합분율(F4)과 광물내 잔류분율(F5) 증가가 작았 으며 대조구와 비슷하였다. 이것은 오염퇴적물에 주입한 생 물활성촉진제의 깊이가 6cm 및 10cm로 증가할 때 유기오염 물의 감량정도가 감소한 것과 같은 경향의 결과이다. 오염퇴 적물에서 황산염환원균 등과 같은 미생물에 의한 생화학반응 이 활발히 일어날 경우 중금속의 존재형태도 크게 변화하는 것으로 판단된다.
5. 결 론
실험실 규모의 관 실험을 통하여 황산염, 질산염 및 초산을 주 요성분으로 하는 생물활성촉진제의 주입 깊이에 따른 연안오 염퇴적물의 생물정화효율을 평가하였으며, 아래와 같은 결론 을 얻었다. 오염퇴적물의 유기오염물질 생물정화에 대한 생물 활성촉진제의 효능은 실험관에 충진한 오염퇴적물의 표면으 로부터 3cm 위치에 생물활성촉진제를 주입할 경우 가장 높았 다. 그러나, 생물활성촉진제의 주입 깊이가 6cm 및 10cm로 증 가함에 따라 유기오염물질 감량율은 점차 감소하였다. 오염퇴 적물에 함유된 중금속의 존재형태 중에서 치환가능분율은 생 물활성촉진제를 충진한 오염퇴적물의 표면에 주입한 경우 가 장 크게 감소하였다. 그러나, 화학적으로 안정하여 퇴적물 내 에서 위해성이 낮다고 평가되고 있는 유기물결합분율(F4)와 광물내 잔류분율(F5)의 합은 유기오염물질 정화효율의 경우와 같이 오염퇴적물에 주입한 생물활성촉진제 주입 깊이가 오염 퇴적물 표면으로부터 3cm일 때 가장 크게 증가하였다. 연안오 염퇴적물의 효과적인 현장생물정화를 위한 적정한 생물활성 촉진제의 주입 깊이는 오염퇴적물의 표층에 해당하는 표면으 로부터 3cm로 평가되었다. 본 연구결과는 현장검증실험을 거 친 후 향후 생물활성촉진제를 이용한 연안오염퇴적물의 현장 생물정화기술로 활용될 것으로 사료된다.
감사의 글
이 논문은 2011년 국토해양부의 재원으로 한국해양과학기 술진흥원의 지원을 받아 수행된 연구임 (지속가능 해양오염 퇴적물 정화기술 개발)
